✦ Que signifie le terme électron ?
✦ Quelles sont les caractéristiques d'un électron ?
✦ Quelle est la charge électrique de l'électron ?
✦ Quelle est la masse de l'électron ?
✦ Que signifie numéro atomique ?
✦ Comment calculer la charge électrique totale du nuage électronique d'un atome ?
✦ Comment calculer la masse totale du nuage électronique d'un atome ?
✦ Quelles sont les caractéristiques d'un électron ?
✦ Quelle est la charge électrique de l'électron ?
✦ Quelle est la masse de l'électron ?
✦ Que signifie numéro atomique ?
✦ Comment calculer la charge électrique totale du nuage électronique d'un atome ?
✦ Comment calculer la masse totale du nuage électronique d'un atome ?
 |
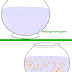
| Schéma d'un atome, les électrons chargés d'électricité négative(-) gravitent autour du noyau qui est chargé d'électricité positive(+). |
🔷 Que signifie le terme électron ?
Les électrons d'un atome sont des particules qui constituent la partie périphérique de cet atome. Les électrons gravitent autour du noyau de l'atome constituant ce que l'on appelle, le nuage électronique. Tous les électrons de tous les atomes sont identiques. Leur symbole est : e-. Ils possèdent tous la même charge électrique et la même masse. Chaque atome, plus précisément chaque élément chimique, est caractérisé par un nombre d'électrons que l'on ne trouve jamais chez d'autres éléments chimiques. Ce nombre d'électrons formant le nuage électronique de chaque atome est appelé : numéro atomique.
🔷 Quelles sont les principales caractéristiques d'un électron ?
un électron est caractérisé par sa charge électrique négative et sa masse faible.
◉ Quelle est la charge électrique de l'électron ?
un électron est caractérisé par sa charge électrique, c'est d'ailleurs la plus petite charge électrique connue. La valeur absolue de la charge électrique de l'électron est notée e. Elle est de l'ordre de 1,602×10⁻¹⁹ C. On l'appelle charge électrique élémentaire. La charge électrique de l'électron est négative, on l'écrira : -e. Les électrons de tous les atomes ont tous la même charge électrique. La valeur de la charge électrique de l'électron est : -e=-1,602×10⁻¹⁹C.
◉ Quelle est la masse de l'électron ?
un électron est caractérisé par sa masse. La masse de l'électron est très faible. Elle n'est pas déterminée directement, mais elle est confirmée par plusieurs mesures indirectes. Les électrons de tous les atomes ont tous la même masse. La valeur de la masse d'un électron est égale à 9,1094×10⁻³¹Kg. On l'écrit de la façon suivante : me-=9,1094×10⁻³¹Kg.
🔷 Que signifie numéro atomique ?
Chaque atome possède un nombre propre d'électrons qui tournent autour de son noyau, ce nombre caractérise chaque atome et il est à la base des différentes propriétés des atomes. Si Z électrons sont en mouvement autour du noyau d'un atome, cet ensemble d'électrons porte une charge électrique totale qui est égale à -Ze. Le nombre Z s'appelle le numéro atomique de l'atome.
◉ Quelques exemples de numéro atomique :
L'atome de Bore possède 5 électrons, son numéro atomique est Z=5
L'atome de Fluor possède 9 électrons, son numéro atomique est Z=9
L'atome de Silicium possède 14 électrons, son numéro atomique est Z=14
L'atome d'Argon possède 18 électrons, son numéro atomique est Z=18
L'atome d'Iode possède 53 électrons, son numéro atomique est Z=53
🔷 Comment calculer la charge électrique totale du nuage électronique d'un atome ?
Puisque le nuage électronique est formé par un ensemble d'électrons ayant chacun une charge électrique négative, alors sa charge électrique totale doit-être forcément négative. Pour calculer la charge électrique totale du nuage électronique dans un atome quelconque, on multiplie le numéro atomique Z de cet atome par la charge électrique élémentaire de l'électron -e=1,602×10⁻¹⁹C. Prenons par exemple quelques exemples d'atomes puis calculons la charge électrique de l'ensemble de tous les électrons qui sont en mouvement autour du noyau de chaque atome. Les atomes que l'on va prendre comme exemple sont : l'atome d'Hydrogène, l'atome de Carbone, l'atome d'Azote, l'atome d'Oxygène, l'atome de Sodium, l'atome de Magnésium, l'atome de Phosphore, l'atome de Chlore, l'atome de Potassium et l'atome de Calcium.
◉ Exemples de quelques charges électriques du nuage électronique chez quelques éléments chimiques :
1. L'atome d'Hydrogène est représenté par le symbole H ; il possède 1 électron d'où son numéro atomique Z=1 ; donc la charge électrique totale de l'ensemble de ses électrons est égal à :
Z×(-e)=-Z×e=-1×1,602×10⁻¹⁹C=-1,602×10⁻¹⁹C
2. L'atome de Carbone est représenté par le symbole C ; il possède 6 électrons d'où son numéro atomique Z=6 ; donc la charge électrique totale de l'ensemble de ses électrons est égale à :
Z×(-e)=-Z×e=-6×1,602×10⁻¹⁹C=-9,612×10⁻¹⁹C
Z×(-e)=-Z×e=-6×1,602×10⁻¹⁹C=-9,612×10⁻¹⁹C
3. L'atome d'Azote est représenté par le symbole N ; il possède 7 électrons d'où son numéro atomique Z=7 ; donc la charge électrique totale portée par l'ensemble ses électrons est égale à :
Z×(-e)=-Z×e=-7×1,602×10⁻¹⁹C=-11,214×10⁻¹⁹C
Z×(-e)=-Z×e=-7×1,602×10⁻¹⁹C=-11,214×10⁻¹⁹C
4. L'atome d'Oxygène est représenté par le symbole O ; il a 8 électrons d'où son numéro atomique Z=8 ; donc la charge électrique totale portée par l'ensemble de ses électrons est égal à :
Z×(-e)=-Z×e=-8×1,602×10⁻¹⁹C=-12,816×10⁻¹⁹C
Z×(-e)=-Z×e=-8×1,602×10⁻¹⁹C=-12,816×10⁻¹⁹C
5. L'atome de Sodium est représenté par le symbole Na ; il possède 11 électrons d'où son numéro atomique Z=11 ; donc la charge électrique totale portée par l'ensemble de ses électrons est égal à :
Z×(-e)=-Z×e=-11×1,602×10⁻¹⁹C=-17,622×10⁻¹⁹C
Z×(-e)=-Z×e=-11×1,602×10⁻¹⁹C=-17,622×10⁻¹⁹C
6. L'atome de Magnésium est représenté par le symbole Mg ; il a 12 électrons d'où son numéro atomique Z=12 ; donc la charge électrique totale de l'ensemble de ses électrons est égale à :
Z×(-e)=-Z×e=-12×1,602×10⁻¹⁹C=-19,224×10⁻¹⁹C
Z×(-e)=-Z×e=-12×1,602×10⁻¹⁹C=-19,224×10⁻¹⁹C
7. L'atome de Phosphore est représenté par le symbole P ; il a 15 électrons d'où son numéro atomique Z=15 ; donc la charge électrique totale portée par l'ensemble de ses électrons est égal à :
Z×(-e)=-Z×e=-15×1,602×10⁻¹⁹C=-24,03×10⁻¹⁹C
Z×(-e)=-Z×e=-15×1,602×10⁻¹⁹C=-24,03×10⁻¹⁹C
8. L'atome de Chlore est représenté par le symbole Cl ; il possède 17 électrons d'où son numéro atomique Z=17 ; donc la charge électrique totale portée par l'ensemble de ses électrons est égal à :
Z×(-e)=-Z×e=-17×1,602×10⁻¹⁹C=-27,234×10⁻¹⁹C
Z×(-e)=-Z×e=-17×1,602×10⁻¹⁹C=-27,234×10⁻¹⁹C
9. L'atome de Potassium est représenté par le symbole K ; il a 19 électrons d'où son numéro atomique Z=19 ; donc la charge électrique totale de l'ensemble de ses électrons est égale à :
Z×(-e)=-Z×e=-19×1,602×10⁻¹⁹C=-30,438×10⁻¹⁹C
Z×(-e)=-Z×e=-19×1,602×10⁻¹⁹C=-30,438×10⁻¹⁹C
10. L'atome de Calcium est représenté par le symbole Ca ; il possède 20 électrons d'où son numéro atomique Z=20 ; donc la charge électrique totale portée par l'ensemble de ses électrons est égal à :
Z×(-e)=-Z×e=-20×1,602×10⁻¹⁹C=-32,04×10⁻¹⁹C
Z×(-e)=-Z×e=-20×1,602×10⁻¹⁹C=-32,04×10⁻¹⁹C
🔷 Comment calculer la masse totale du nuage électronique d'un atome ?
Chaque atome possède un ensemble d'électrons qui tournent autour du noyau formant ainsi un nuage électronique. chaque électron a une masse très faible, me-=9,1094×10⁻³¹Kg. Dans un atome quelconque, la masse du nuage électronique est la somme des masses de tous les électrons qui gravitent autour du noyau de cet atome. Si un atome possède Z électrons, la masse de son nuage électronique sera égale à Z×me-=Z×9,1094×10⁻³¹Kg. Pour calculer la masse de l'ensemble des électrons dans un atome, on multiplie le numéro atomique Z de cet atome par me- qui est la masse de l'électron. Prenons quelques exemples d'atomes, puis calculons la masse de l'ensemble de ses électrons. Nous allons prendre comme exemple l'atome d'Hélium, l'atome de Bore, l'atome de Fluor, l'atome de Néon, l'atome d'Aluminium, l'atome de Silicium, l'atome de Soufre, l'atome d'Argon, l'atome de Brome et l'atome d'Iode.
◉ Quelques exemples des masses totales des nuages électroniques chez quelques atomes :
1. L'atome d'Hélium est représenté par le symbole He ; il possède 2 électrons d'où son numéro atomique Z=2 ; la masse de l'ensemble de ses électrons est égal à :
Z×me-=Z×9,1094×10⁻³¹Kg=2×9,1094×10⁻³¹Kg=18,2188×10⁻³¹Kg
2. L'atome de Bore est représenté par le symbole B ; il possède 5 électrons d'où son numéro atomique Z=5 ; la masse de l'ensemble de ses électrons est égal à:
Z×me-=Z×9,1094×10⁻³¹Kg=5×9,1094×10⁻³¹Kg=45,547×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=5×9,1094×10⁻³¹Kg=45,547×10⁻³¹Kg
3. L'atome de Fluor est représenté par le symbole F ; il possède 9 électrons d'où son numéro atomique Z=9 ; la masse de l'ensemble de ses électrons est égal à :
Z×me-=Z×9,1094×10⁻³¹Kg=9×9,1094×10⁻³¹Kg=81,9846×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=9×9,1094×10⁻³¹Kg=81,9846×10⁻³¹Kg
4. L'atome de Néon est représenté par le symbole Ne ; il possède 10 électrons d'où son numéro atomique Z=10 ; la masse de l'ensemble de ses électrons est égal à :
Z×me-=Z×9,1094×10⁻³¹Kg=10×9,1094×10⁻³¹Kg=91,094×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=10×9,1094×10⁻³¹Kg=91,094×10⁻³¹Kg
5. L'atome d'Aluminium est représenté par le symbole Al ; il possède 13 électrons d'où son numéro atomique Z=13 ; la masse de l'ensemble de ses électrons est égal à :
Z×me-=Z×9,1094×10⁻³¹Kg=13×9,1094×10⁻³¹Kg=118,4222×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=13×9,1094×10⁻³¹Kg=118,4222×10⁻³¹Kg
6. L'atome de Silicium est représenté par le symbole Si ; il possède 14 électrons d'où son numéro atomique Z=14 ; la masse de l'ensemble de ses électrons est égal à :
Z×me-=Z×9,1094×10⁻³¹Kg=14×9,1094×10⁻³¹Kg=127,5316×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=14×9,1094×10⁻³¹Kg=127,5316×10⁻³¹Kg
7. L'atome de Soufre est représenté par le symbole S ; il possède 16 électrons d'où son numéro atomique Z=16 ; la masse de l'ensemble de ses électrons est égal à:
Z×me-=Z×9,1094×10⁻³¹Kg=16×9,1094×10⁻³¹Kg=145,7504×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=16×9,1094×10⁻³¹Kg=145,7504×10⁻³¹Kg
8. L'atome d'Argon est représenté par le symbole Ar ; il possède 18 électrons d'où son numéro atomique Z=18 ; la masse de l'ensemble de ses électrons est égal à :
Z×me-=Z×9,1094×10⁻³¹Kg=18×9,1094×10⁻³¹Kg=163,9692×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=18×9,1094×10⁻³¹Kg=163,9692×10⁻³¹Kg
9. L'atome de Brome est représenté par le symbole Br ; il possède 35 électrons d'où son numéro atomique Z=35 ; la masse de l'ensemble de ses électrons est égal à :
Z×me-=Z×9,1094×10⁻³¹Kg=35×9,1094×10⁻³¹Kg=318,829×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=35×9,1094×10⁻³¹Kg=318,829×10⁻³¹Kg
10. L'atome d'Iode est représenté par le symbole I ; il possède 53 électrons d'où son numéro atomique Z=53 ; la masse de l'ensemble de ses électrons est égal à :
Z×me-=Z×9,1094×10⁻³¹Kg=53×9,1094×10⁻³¹Kg=428,7982×10⁻³¹Kg
Z×me-=Z×9,1094×10⁻³¹Kg=53×9,1094×10⁻³¹Kg=428,7982×10⁻³¹Kg
Conclusion :
Les électrons sont des particules qui constituent la partie périphérique d'un atome. Ils sont chargés d'électricité négative.
Les électrons sont des particules qui constituent la partie périphérique d'un atome. Ils sont chargés d'électricité négative.
Les électrons d'un atome forment un nuage électronique en gravitant autour du noyau qui est chargé d'électricité positive.
La charge électrique de l'électron est la charge électrique élémentaire -e=-1,602×10⁻¹⁹C. La masse de l'électron est me-=9,1094×10⁻³¹Kg.
Si un atome possède Z électrons qui tournent autour de son noyau, Ce nombre Z est appelé numéro atomique de l'atome considéré.
Les atomes qui sont connus jusqu'à maintenant ont des numéros atomiques qui varient entre Z=1 et Z=118 .
La charge électrique de l'ensemble des électrons d'un atome est égale à -Z×1,602×10⁻¹⁹C.
La masse de l'ensemble des électrons d'un atome est égale à Z×9,1094×10⁻³¹Kg.
🌹🌹🌹 Hi 🙏 Cher(e) visiteur(euse)😍❕ Si vous avez trouvé cet article utile, veuillez le partager avec vos amis pour nous aider à faire connaître NatureLovers❕ Merci d'avance 🙏🌹🌹🌹
ARTICLES RECOMMANDÉS POUR VOUS :










Aucun commentaire:
Enregistrer un commentaire